- FORMACIÓN
Los óxidos ácidos o anhídridos están formados por la combinación de un No Metal y el Oxígeno molecular gaseoso. En forma simbólica: No Metal + O2 ----------------------> Óxido Ácido o Anhídrido
- NOMENCLATURA
- SISTEMATICA
Ejemplos:As2S3 (trisulfuro de diarsénico); PF5 (pentafluoruro de fósforo).
- Stock
Los óxidos, tanto ácidos como básicos se nombran mediante las palabras "óxido de", seguida del nombre del elemento y un paréntesis donde se pone la valencia del elemento en números romanos, tal y como estaba al principio sin simplificar. Si un elemento tiene solo una valencia no se pone paréntesis.
Ejemplos:Fe2O3 (óxido de hierro III); SO3 (óxido de azufre (VI); FeO (óxido de hierro II); Na2O (óxido de sodio).
- Tradicional
Para los óxidos básicos:
- Si el metal con el que se combina tiene una sola valencia, se nombran con las palabras óxido de, y el nombre del metal con el que se combina.Ejemplos: CaO (óxido de calcio); Na2O (óxido de sodio).
- Si el metal con el que se combina tiene dos valencias, se pone como en el de una valencia pero el nombre del metal acaba en oso cuando actúa con la valencia menor y en ico cuando actúa con la valencia mayor y se le quita el prefijo "de".
Ejemplos: FeO (óxido ferroso, el hierro tiene en este caso valencia 2 y se simplifica); Fe2O3 (óxido férrico, el hierro tiene en este caso valencia 3).
Para los óxidos ácidos:
- Si el no metal con el que se combina tiene una sola valencia se nombran con las palabras óxido de, y el nombre del metal con el que se combina acabado en ico.Ejemplos: B2O3 (óxido bórico.
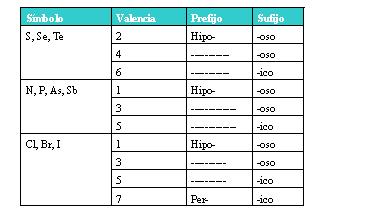
- Si el no metal con el que se combina tiene dos o más valencias, se ponen al nombre las siguientes terminaciones:
Ejemplos: Br2</sub<subO5 (óxido brómico); Cl2O7 (óxido brómico).
- FORMULA
Al escribir la fórmula química de los óxidos no metálicos, se escribe primero el símbolo del elemento no metálico y a continuación el del oxígeno. Se colocan subíndices de acuerdo con el número deátomos que hay de cada elemento químico
Se expresa en símbolos los elementos Carbono y oxigeno.
CIV + O2 ---------> .................
Mediante la elaboración de la fórmula desarrollada, podemos expresar la fórmula molecular de dicho óxido ácido. Entonces: C + O2 -----------------> CO2
- EJERCICIOS DESARROLLADOS
1- A. Perclórico= Cl2O7
2- A. Clórico= Cl2O5
3- A. Cloroso= Cl2O3
4- A. Hipocloroso= Cl2O
5- A. Fosfórico= P2O5
6- A. Fosforoso=P2O3
7- A. Nítrico=N2O5
8- A. Nitroso=N2O3
9- A. Carbónico=CO2
10- A. Carbonoso=CO
11-A. Sulfúrico= SO3
12- A. Sulfuroso= SO2
13- A. Hiposulfuroso=SO
14- A. Arsénico=As2O5
15- A. Selénico= SeO3.
No hay comentarios:
Publicar un comentario